COVID19の変異株について
2019年中国武漢より世界中に拡散したと推定されている新型コロナウイルス(SARS-COV2)は、既知のβコロナウイルスであるSARS-COV1と76%の遺伝子相同性を有している(1)。SARS-COV2は、スパイク蛋白を用いてアンギオテンシン変換酵素type2(ACE2)を発現している細胞に感染し増殖する。スパイク蛋白のアミノ酸変異はウイルスの感染力と毒性(病原性)、免疫逃避性に重大な変化を起こすことがわかっている(see→Case24-8 part2 )。ここ3年間でSARS-COV2は、α株→ο株までギリシャ文字の順番から数えると14回(ξは何故か命名を除外された)メジャーな変異を生じ人体に対する表現型を変化させて来たが今のところ致死率が2%を超えるような変異は起こしていない(恐らく暮にはπと命名される変異種が出現するだろう)。逆に言うと同様にACE2を介して人に感染するSARS-COV1(致死率最大で10%)との人体毒性の違いは、異なる24%のウイルス遺伝子配列の中に封入されていると考えられる。SARS-COV2-ο株はスパイク蛋白に32箇所のアミノ酸変異を獲得した事による、現在までに確認されている変異株中最大の感染力を獲得しα株に対する中和抗体をエスケープする能力を有する(下図1(2))。致死率の増強は今のところ認められないが、現状では50歳以下の感染者が多くを占め、過去株に比べ桁違いの新規感染者が連日発生するため分母を新規総感染者数にとると致死率が過小評価されていることは自明である。そもそもα株の時から死亡症例の大多数は65歳以上であり、SARS-COV2の致死率は全体の罹患数に対して65歳以上が罹患した割合により大きく変動する(分散が大きいのはこの年齢層である)。
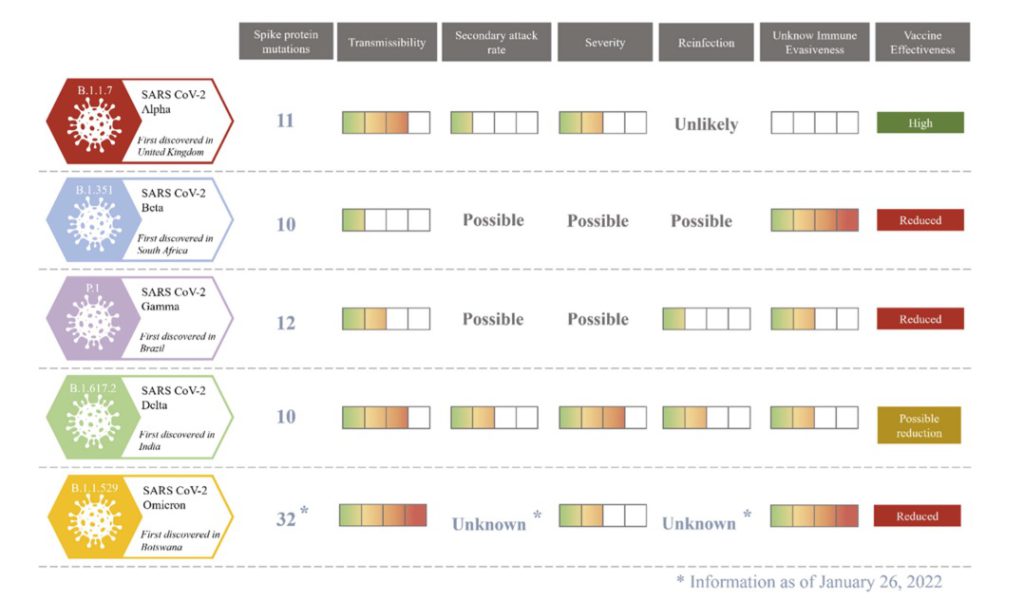
さてスパイク蛋白のアミノ酸変異数とその部位によって、病原性がどう変化するかは医師のみでなく全国民が興味のあるところであるが、次に何処に何個の変異が生じるかを差分方程式(または微分方程式)を用いて予測するのは極めて困難と考えれらる。ただわかるのは、マルコフ連鎖に従いランダムウオークで表せるような変化をすることは推定できる。この法則に従う以上、次の変異株の病原性Xn+1を予測するにあたり、前の株の病原性Xnしか参考データとしてあてにならない。特に異種間移動できるウイルスでは、ネズミなどに一旦移動してから再びヒトに戻ってきた場合予想外の病原性の増強または減弱が起こる可能性がある。離散データとして数値化可能なのは現在までの変異株で生じた病原性の分散であり、分散がこの範囲におさまって変異する限りは大きな病原性の増大(逆に低下も)は急に生じるとは考えられない。
①Type”L”とType”H”の新型コロナウイルス肺炎
新型コロナウイルス肺炎( COVID-19 pneumonia)は、 下表1 のように症状経過と相互作用の特徴から”type L”とtype”H”の2パターンに分類される(3)。
| COVID19肺炎のパターン | |
| Type L | 〇肺の伸縮性が良好(ほぼ正常) 〇軽度の換気血流不均衡(肺動脈圧正常) 〇肺重量の軽度増加(CT画像的にはGGOが胸膜下に認められる程度) 〇換気不良の肺胞が少なく、一時的に高めの気道内圧を加えることで容易に虚脱した肺胞を再開通できる(リクルートメント効果が小さい) |
| Type H | 〇肺の伸縮性が低下(浮腫による含気減少) 〇左右シャントによる 重度の低酸素血症 〇肺重量の著明な増加 (>1.5kg) 〇換気不良域の著明な増加により、高い気道内圧を加えても虚脱した肺胞の再開通は難しい(リクルートメント効果が大きい) |
重篤な成人型呼吸窮迫症候群(ARDS)に相当するのがType Hということになるが、この段階では、人工呼吸器やECMOの装着が必須である。このような重度の呼吸不全に陥る原因にはCOVID19感染症独特の血液凝固異常の機序が関与している。
②COVID19 Associated Coagulopathy (CAC)とは
“coaglopathy”とは血液凝固異常を示し、SARS-COV2感染では血栓塞栓症の合併症が多く報告されている。ICU収容症例では血栓塞栓症(特に肺血栓塞栓症)の合併は重大な予後決定因子である。血栓症の合併は、死亡リスクを5.4倍上昇させる(4)。Obaらによる本邦の報告では、β、δ株の入院患者516症例のうち血栓塞栓症は32症例(42イベント)認められ、これらは人工呼吸管理などを受ける重症患者の13%、酸素投与を受けていない重症ではない症例の2.5%に認められた(5)。
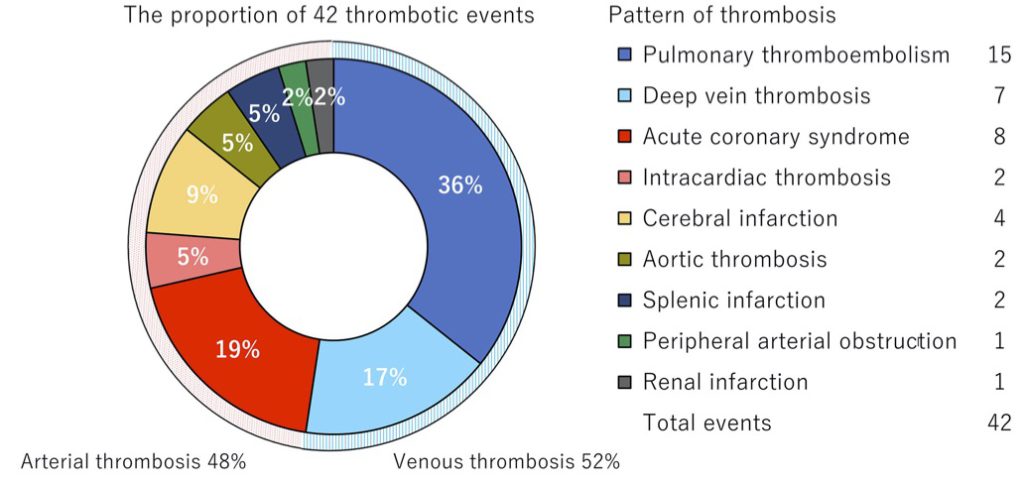
図1にその内訳が示してあるが、入院患者に認められた血栓塞栓症の発症頻度は5.3%であり、半数は静脈血栓症(52%)であった。このうち肺血栓塞栓症の占める割合は36%と最多である(5)。肺血栓症は深部静脈血栓症を伴っていないことが注目される。動脈血栓症の合併も同等に認められ、急性冠症候群が多く認められた。脳梗塞、腎梗塞なども認められたが、心房細動の際によく生じる消化管の動脈血栓症(上腸間膜動脈血栓塞栓症など)は認めなかった。血栓塞栓症を生じた症例は入院時の血清D-ダイマー及びフェリチン値が高値である特徴を示していた(5)。CACにおいて、血中D-ダイマーのモニタリングは重要で、進行症例でない限り凝固因子活性の指標であるプロトロンビン時間(PT)や部分活性化トロンボプラスチン時間(APTT)の延長は認めないことが多い(4)。典型的なCACは、D-ダイマー、フィブリノーゲン、フォンビルブランド因子(WWF)の上昇に対して、PT, APTTは正常で血小板数の低下が軽微であるのが特徴である(6)。
CACを構成する3つの主要な要素は、
(1) アンギオテンシンII 誘発性血液凝固異常 ( Ang Ⅱ-induced coagulopathy )
(2) XII因子ーカリクレインーキニン系(KKS)により増強されたHyperfibrinolysis
(3) 播種性血管内凝固症候群(DIC)
である。
SARS-COV2は、血液凝固亢進(hypercoagulability)、血小板活性化、内皮細胞機能不全を特徴とした急性炎症を引き起こす(7)。
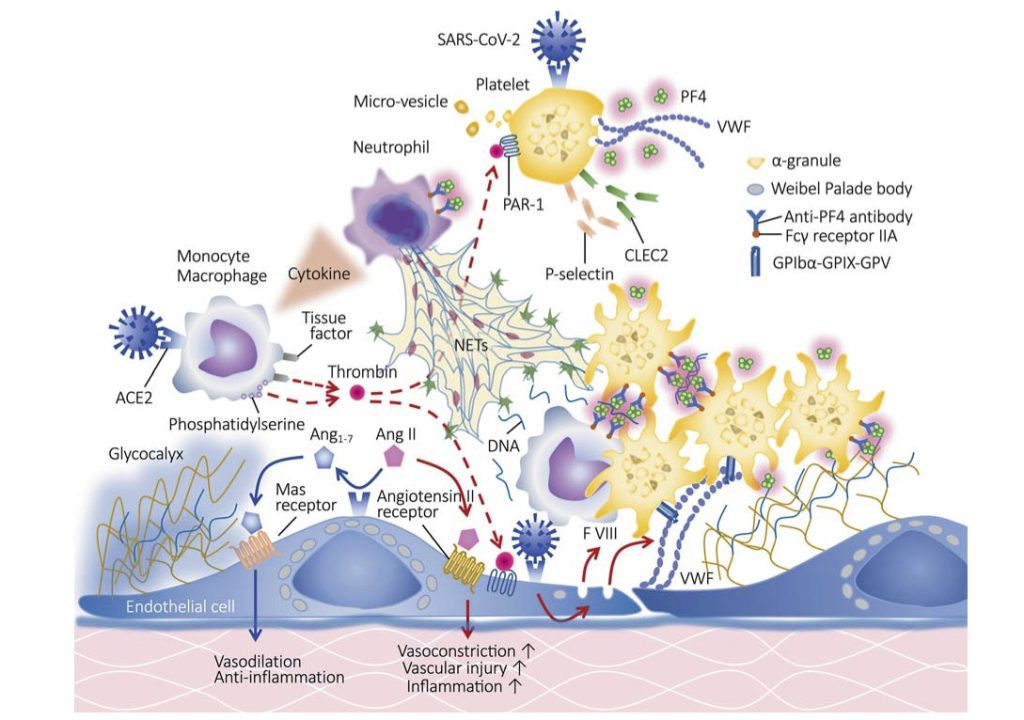
CACは、ACE2を表面に発現した細胞のうち、肺胞2型上皮細胞、免疫系細胞、血管内皮細胞をSARS-COV2が感染のメインターゲットとしていることにより生じる(5)。CACの発症に大きく関与しているのがレニンーアンギオテンシン(Ang)系(RAS)の不均衡である(8)。CACの根幹は、アンギオテンシン2誘発性の血液凝固異常 ( Ang Ⅱ-induced coagulopathy )である(9)。スパイク蛋白に結合されたACE2は本来の酵素活性(Ang Ⅱ→Ang1-7への異化活性)を失う。したがってACE2を侵略された血管局所の内皮細胞近傍はアンギオテンシンⅡ(Ang II)の過剰状態となり内皮細胞のNO産生は抑制され、その結果血管は”しなやかさ”を失う。Ang IIの作用により血管は過剰収縮し、proinflammatory cytokineが産生される(図2)。
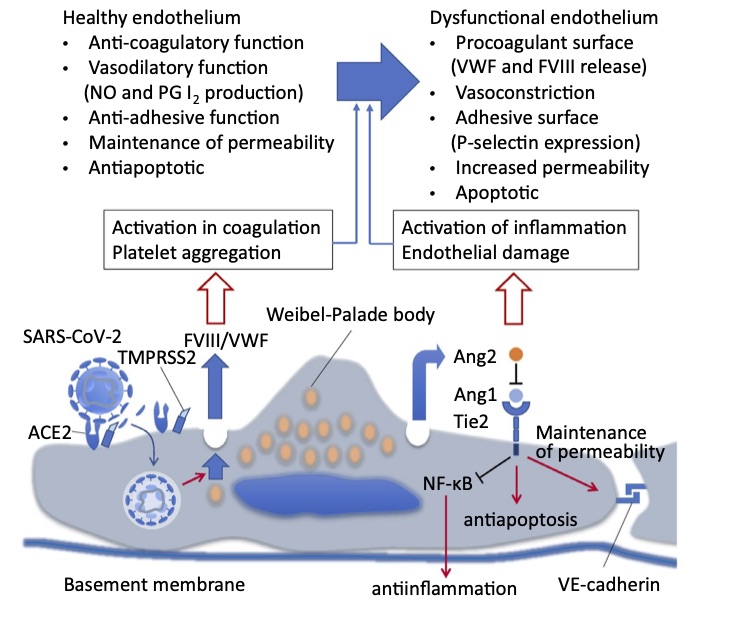
ACE2を発現している単核球やマクロファージにSARS-COV2が侵入すると多種類のサイトカイン(cytokine)やTissue Factor(TF)が放出され、好中球を活性化しNET (Neutrophil extracellular trap) が放出される。一方SARS-COV2が侵入した血小板からは、α顆粒に含まれるP-secletinやPF4が放出される(図3)。これらにより活性化された血小板は好中球や単核球などの免疫担当細胞と共に局所の微小血栓(Immunothrombosis)を形成する。 Immunothrombosis により血管の閉塞→低酸素血症が引き起こされ組織障害はさらに増悪する。COVID19感染症では、肺胞の毛細血管の微小血栓がインフルエンザウイルス感染症の9倍の高頻度で認められる(10)。
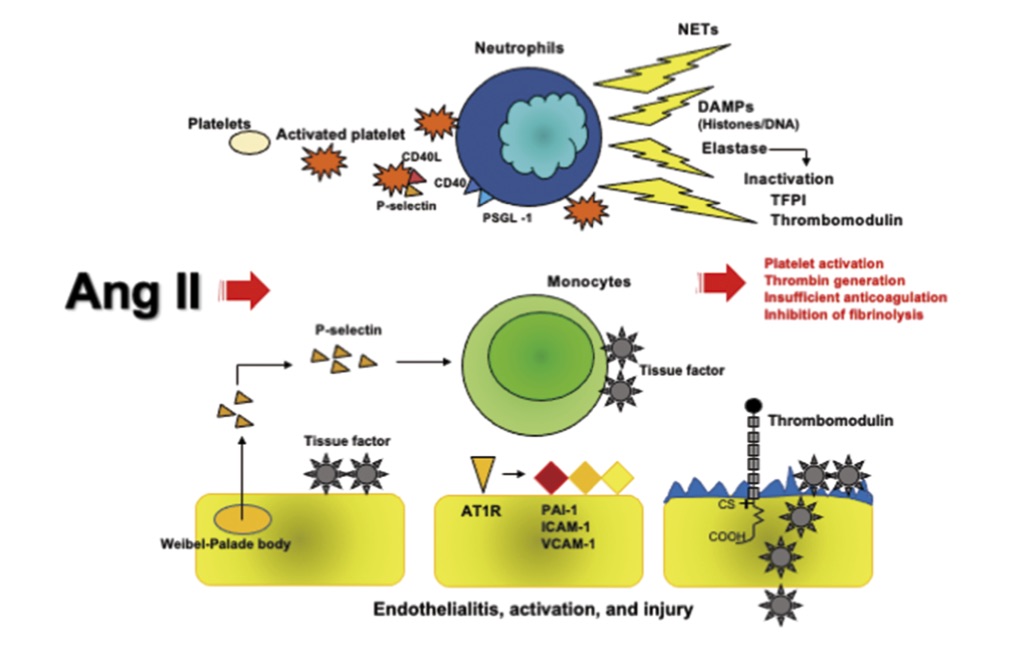
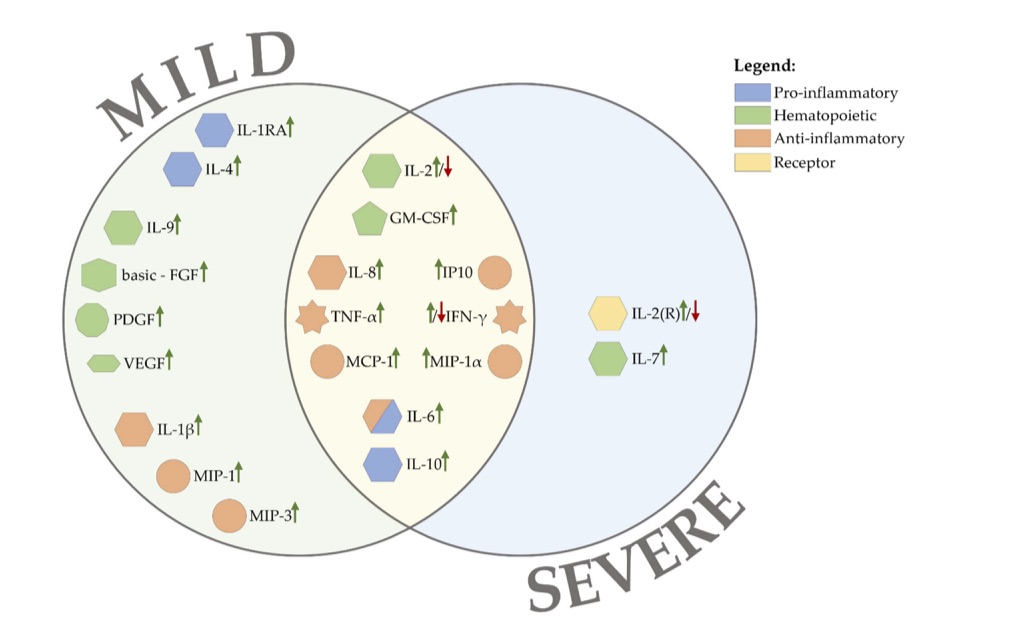
図4は、SARS-COV2感染症の軽症例と重症例で特徴的なサイトカインを示してある(2)。SARS-COV2感染では、炎症性サイトカインの血中レベルの上昇が認められ、過剰なサイトカイン産生は血球貪食症候群(HLH/MAS)を誘発し血栓性凝固異常へ進展していく(9)。
②Immunothrombosisとは?
COVID19の初感染部位は深部鼻粘膜であるが、肺に到達すると局所肺胞に炎症を引き起こす。Ang Ⅱ-induced coaglopathyによる炎症が主じた肺胞周囲の微小循環において、下図5の様に血小板の活性化、トロンビン産生、プラスミノーゲン活性化阻害因子-1の発現が起こるとともに血管内皮障害に伴い局所血栓形成に至る(7)。
SARS-COV2 RNAは、NET(Neutrophil extracellular trap)-DNAとともにXII因子を活性化し、XIIa因子とカリクレインを介したプラスミノーゲン→プラスミンへの変換とブラジキニンによる血管内皮からのt-PA(Tissue Plasminogen Activator)放出を引き起こす(図6)。
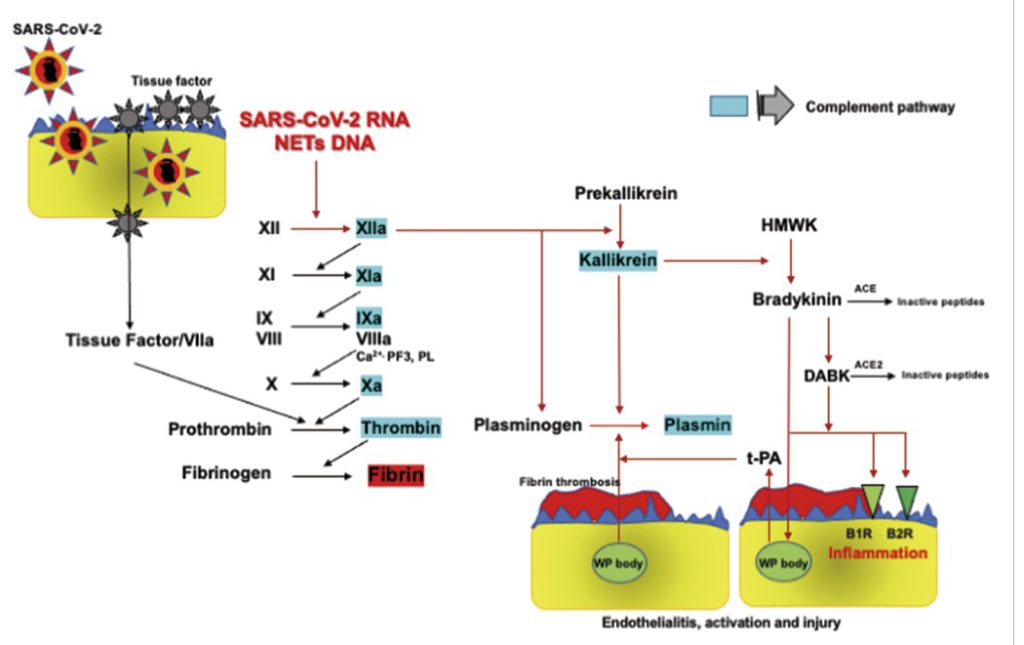
NETに単核球やマクロファージの様な免疫担当細胞が取り込まれて活性化血小板と一塊になったものを免疫血栓(immunothrombosis)と呼ぶ。重篤な炎症反応が全身性に生じた場合、免疫血栓は全身へ広がり最終的にDICに至ると考えられている(Thromboplasminflammation)(11)。
③COVID19における播種性血管内凝固症候群(DIC)
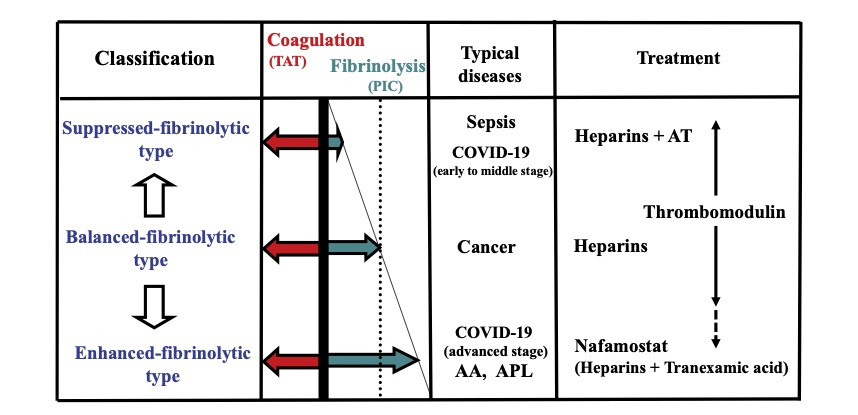
DICは、下表2の様に大まかに3種類に分類される。
| Suppresed-fibrinolytic-type DIC | ●凝固>>線溶の状態(過凝固) ●敗血症に合併するDICの典型 ●微小血栓の多発が特徴 ●lipopolysaccharide (LPS), サイトカイン[ tumor necrosis factor (TNF), Interleukin (IL-1など)] の刺激により単球/マクロファージ、血管内皮細胞から大量のtissue factor (TF)産生→過凝固 ●LPS, サイトカイン→血管内皮細胞のトロンボモジュリン発現抑制、plasamin activator inhibitor (PAI)の過剰発現→線溶の抑制 |
| Enhanced-fibrynolytic-type DIC | ● 線溶>>凝固の状態 ●白血病などの悪性血液腫瘍に合併するDICの典型 ●出血傾向が著明(微小血栓(-)) ●白血病細胞からのTFの血中放出が原因 |
| Balanced-fibrinolytic-type DIC | ●凝固=線溶の状態 ●悪性腫瘍(固形癌)に 合併するDIC の典型 ●血栓/出血ともに病期が進行するまで稀 |
COVID19感染症においては、Ang II-induced coagulopathyにより病初期から線溶抑制型のDICの傾向に傾くため、一見軽症に見えても突然血栓塞栓症(特に肺血栓塞栓症や冠動脈血栓塞栓症)を生じることがあるため突然死のリスクがあることに注意が必要である、重症化が進むと最終的には線溶亢進型DICへと進展する(12)。上記を考慮した上で、大部分の入院症例に対しては標準的な抗血栓療法が行われているが血栓塞栓症の発症を予防するには至っていない。
COVID19-DICに対しては下図7のような抗凝固薬の併用が望ましいと考えられる(13)。
結語
新型コロナウイルス感染症に伴う肺炎の重症化には 、COVID19 Associated Coagulopathy (CAC)と呼ばれる特徴的な血液凝固異常が関与している。肺胞周囲の毛細血管に免疫血栓(Immunothrombosis)と呼ばれる微小血栓が多発することにより低酸素血症→組織障害の増悪へと連鎖していき、全身に波及すると重度のDICに至り致命的となる場合がある。COVID19感染症の注意すべき合併症は動静脈の血栓塞栓であり、特に肺血栓塞栓症、冠動脈血栓塞栓症は軽症経過であっても突然死の原因となりうる病態であり自宅療養の際には前もって対応を考慮しておく必要がある。
Uploaded on August 14, 2022.
参考文献
- Hoffman N, Klein-Weber H, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020; 181(2): 271-280.
- Niedz ́wiedzka-Rystwej P, Majchrzak A, et al. Immune signature of COVID-19: In-depth reasons and consequences of the cytokine storm. Int. J. Mol. Sci. 2022, 23, 4545. https://doi.org/10.3390/ijms23094545
- Gattinoni L, Chiumello D, et al. COVID-19 pneumonia: different respiratory treatments for different phenotypes? Intensive Care Med (2020) 46:1099–1102. https://doi.org/10.1007/s00134-020-06033-2
- Klok FA, Kruip MJHA, et al. Confirmation of the high cumulative incidence of thrombotic complications in critically ill ICU patients with COVID-19: An updated analysis. Thromb Res. 2020;S0049–3848(20):30157–62.
- Oba S, Hosoya T, et al. Arterial and Venous Thrombosis Complicated in COVID-19: A Retrospective Single Center Analysis in Japan. Frontiers in Cardiovascular Medicine 2021;8: Article 767074
- Iba T, Connors JM, et al. The coagulopathy, endotheliopathy, and vasculitis of COVID‐19. Inflammation Research. 2020; 69:1181–1189 https://doi.org/10.1007/s00011-020-01401-6
- Iba T, Wada H, et al. Platelet activation and thrombosis in COVID-19. Seminars in Thrombosis & Hemostasis © 2022. Thieme
- Levi M, Thachil J, et al. Coagulation abnormalities and thrombosis in patients with COVID-19. Lancet Haematol. 2020;7(6):e438–e440.
- Brojakowska A, Narula J, et al. Clinical implications of SARS-CoV-2 interaction with renin angiotensin system. JACC Review Topic of the Week. JACC 2020; 75(24):3085–95
- Ackermann M, Verleden SE, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19.N Engl J Med. 2020; 383(2): 120–128. doi:10.1056/NEJMoa2015432.
- Gando B, Wada T. Thromboplasminflammation in COVID-19 coagulopathy: Three viewpoints for diagnostic and therapeutic strategies. Frontiers in Immunology. 2021;12: Article 649122 doi: 10.3389/fimmu.2021.649122
- McGonagle D, et al. Immune mechanisms of pulmonary intravas- cular coagulopathy in COVID-19 pneumonia. Lancet Rheumatol.2020
- Asakura H. Diversity of disseminated intravascular coagulation and selection of appropriate treatments. International Journal of Hematology (2021) 113:10–14. https://doi.org/10.1007/s12185-020-03030-5
院長の独り言
COVID19第7ウエーブが強襲している。欧米諸国との背景を考慮せずウィズコロナに迎合すればこのようになることは十分予見できたことである。ロックダウンや人流抑制、都市封鎖などの公衆衛生対策として提案されている数理モデルは新規感染者の総数5,000人を上限として計算されたモデルである故、感染者が増大した時点でこのような対策を導入しても効果は期待できないのは当たり前である。境界条件をきちんと踏まえたうえで施行すべきであるが、今のところきちんと条件式に合わせて理論的に施行できている国は中国のみである。恐らくコロナウイルスが多く含まれるエアロゾル粒子の直径が以前よりより小さい分画に移行することでより効率的に直面会話での感染することが可能となったと考えられ、KN95クラスの不織布マスクの着用でも油断できない状況になっているのであろう。そもそもフィルターの装備されていない布マスクやウレタンマスクは着用していないのとほぼ同じ条件であり、何の役にも立っていない上に熱中症のリスク因子となりうることをきちんと国民は理解すべきである。さすがにここまで感染拡大するとウイルスが勝手に減少してくるのを待つしかないが、感染者数が今になって世界最多となったのは恥の上塗りといえよう。結核、エイズに続き新型コロナウイルス感染症においてまでルーズな管理をする先進国としてさらに低い評価を世界から受けるのは残念なことである。ただ少し心配なのはこの状況が9月末まで続くなら今年はインフルエンザウイルスとの2重感染が生じる可能性は高いと考えられ死者は極端に増加するのではないかという懸念。ただ現時点では、当初ほど致命的となりうる血栓塞栓症の合併は減少していると考えられる。ただし、これがワクチンの重症化予防効果として表現されているものなのか、もしくはο-株独特の変異によるものなのかははっきりしない。ワクチン未接種者における血栓塞栓症の合併率がどの程度なのかは全数調査できちんと把握すべきであると考える。